P মৌলের পারমাণবিক সংখ্যা ১১ ও ভর সংখ্যা ২৩। ০ মৌলের ইলেকট্রন সংখ্যা ১৭।
উদ্দীপক অনুযায়ী, ঐ মৌলের পারমাণবিক সংখ্যা ১১। তাই মৌলটি সোডিয়াম। অপরদিকে Q মৌলের পারমাণবিক সংখ্যা ১৭। তাই মৌলটি ক্লোরিন। মৌলদ্বয়ের ইলেকট্রন বিন্যাস নিয়ে পাই
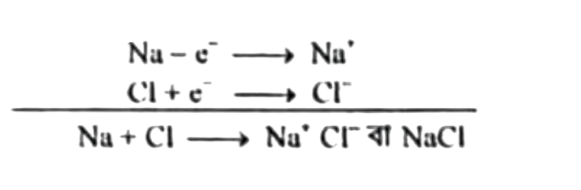
ইলেকট্রন বিন্যাস হতে দেখা যাচ্ছে, Na এর সর্বশেষ স্তরে ১টি এবং ক্লোরিনের সর্বশেষ স্তরে ৭টি ইলেকট্রন আছে। সোডিয়াম তার সর্ববহিঃস্থ শক্তিস্তর থেকে ১টি ইলেকট্রন ত্যাগ করে নিকটস্থ নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস অর্জন করে।
অপরদিকে ক্লোরিনের সর্বশেষ স্তরে ৭টি ইলেকট্রন আছে যা ত্যাগ করা কঠিন। তাই ক্লোরিন ১টি ইলেকট্রন গ্রহণ করে নিকটস্থ নিষ্ক্রিয় গ্যাস আর্গনের ইলেকট্রন বিন্যাস অর্জন করে।
ফলে তাদের মধ্যে একটি আকর্ষণ বল কাজ করে এবং তারা একে অন্যের সাথে আয়নিক বন্ধনে আবদ্ধ হয়ে যৌগ গঠন করে।
বিক্রিয়া:
আপনি আমাকে যেকোনো প্রশ্ন করতে পারেন, যেমনঃ
Are you sure to start over?